








| 鼓膜穿孔部の大きさ | 鼓膜用ゼラチンスポンジの直径 |
|---|---|
| 1/3未満 | 約3mm |
| 1/3以上、2/3未満 | 約7mm |
| 2/3以上 | 約10mm |




| 目的 | 鼓膜穿孔を有する患者を対象として、トラフェルミン(遺伝子組換え)浸潤ゼラチンスポンジを用いた鼓膜再生療法の有効性及び安全性を検討する。 |
|---|---|
| 試験デザイン | 多施設共同、非盲検、非対照試験 |
| 対象 | 鼓膜穿孔6ヵ月以上経過した自然閉鎖が認められない鼓膜穿孔患者20例 |
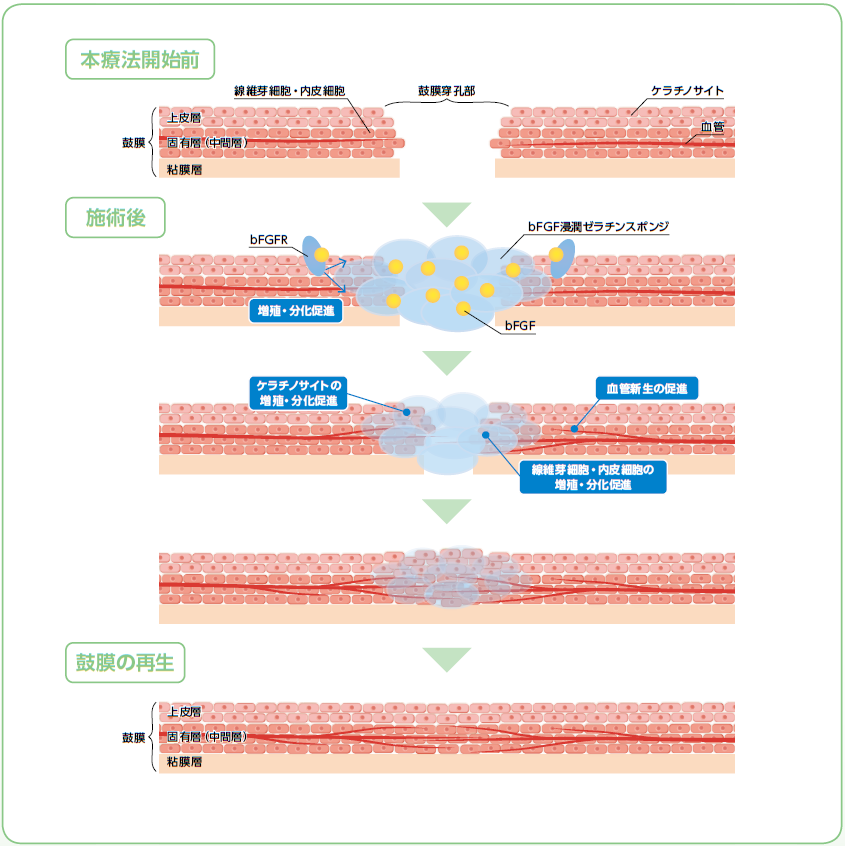
| 治療方法 | トラフェルミン(遺伝子組換え)(100μg/mL)を適量浸潤させたゼラチンスポンジ(トラフェルミン(遺伝子組換え)浸潤ゼラチンスポンジ)を鼓膜穿孔の大きさや形状に合わせて円形に成形し、鼓膜穿孔縁の新鮮創化後、鼓膜穿孔部位を十分覆うように留置し、組織接着剤(フィブリン糊)数滴で接着・閉鎖した。組織接着剤(フィブリン糊)の使用量は、鼓膜穿孔の程度がグレードⅠで1~2滴、グレードⅡで2~3滴、グレードⅢで3~4滴とした。 |
| 評価項目 |
主要評価項目 :
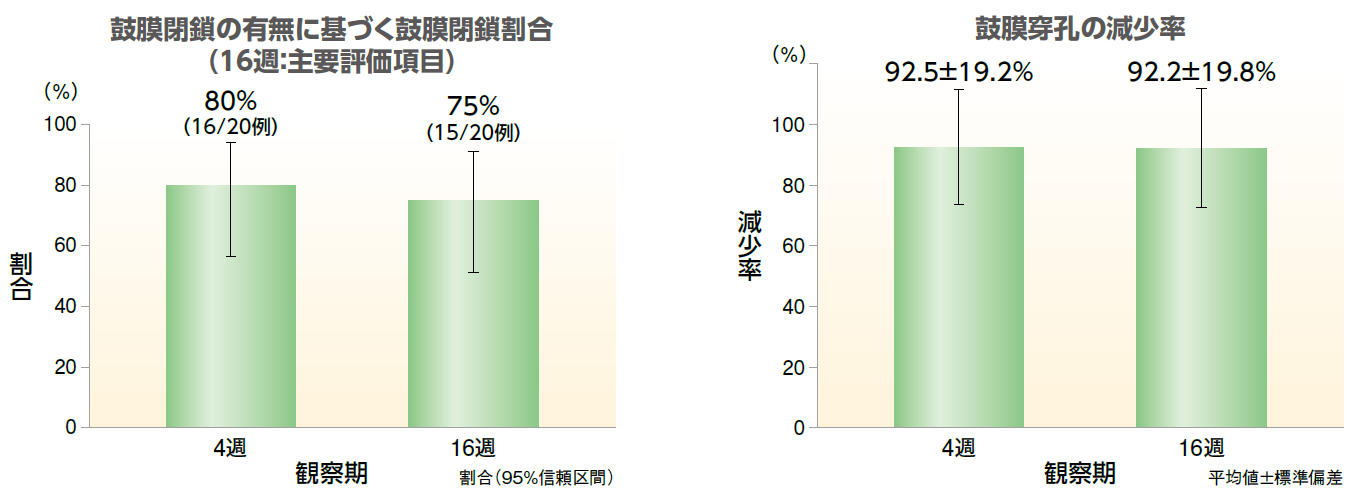
観察期16週目における鼓膜閉鎖の有無(画像評価委員会判定)
副次評価項目 :
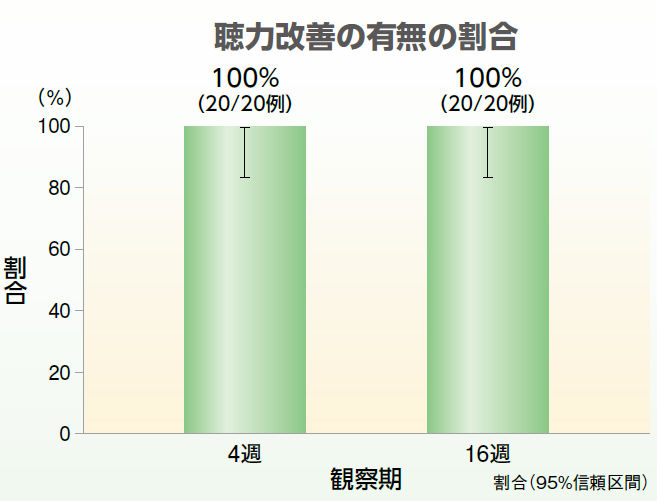
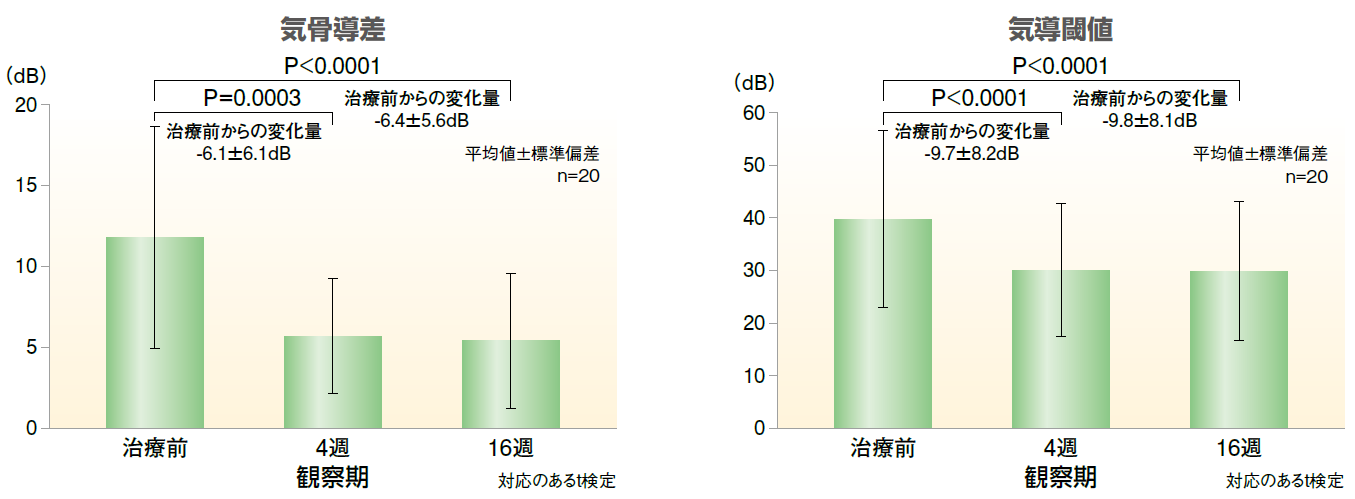
鼓膜閉鎖の有無(観察期4週目)、鼓膜穿孔の減少率(観察期4週目及び16週目)、気骨導差及び気導閾値(観察期4週目及び16週目)など
安全性評価項目:
有害事象及び副作用
|
| 解析計画 | 主要評価項目は、観察期16週目における鼓膜閉鎖割合とその95%信頼区間を推定した。鼓膜閉鎖割合の95%信頼区間の下限が50%よりも高ければ、本鼓膜再生療法が有効であると判断することとした。 |


| 目的 | 鼓膜再生療法の有効性及び安全性について、プラセボを対照に検討する。 |
|---|---|
| 試験デザイン | 無作為化、プラセボ対照試験 |
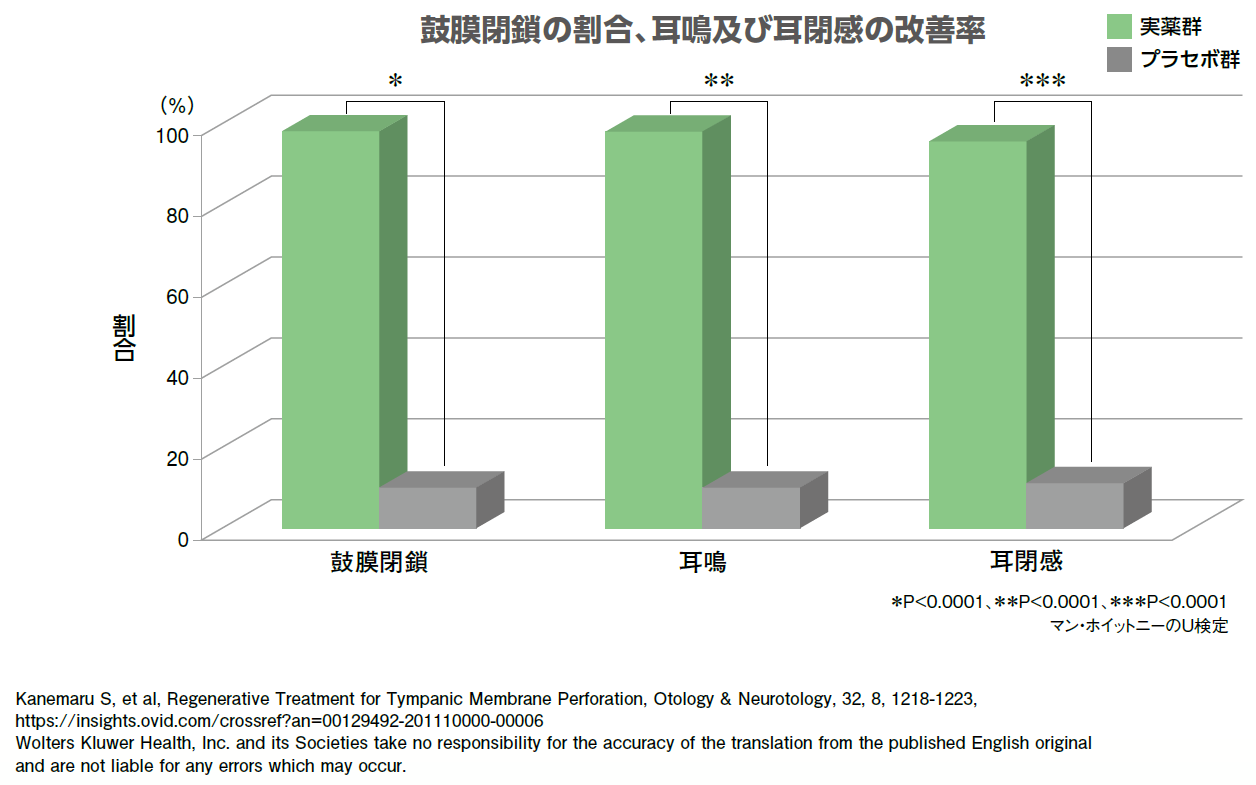
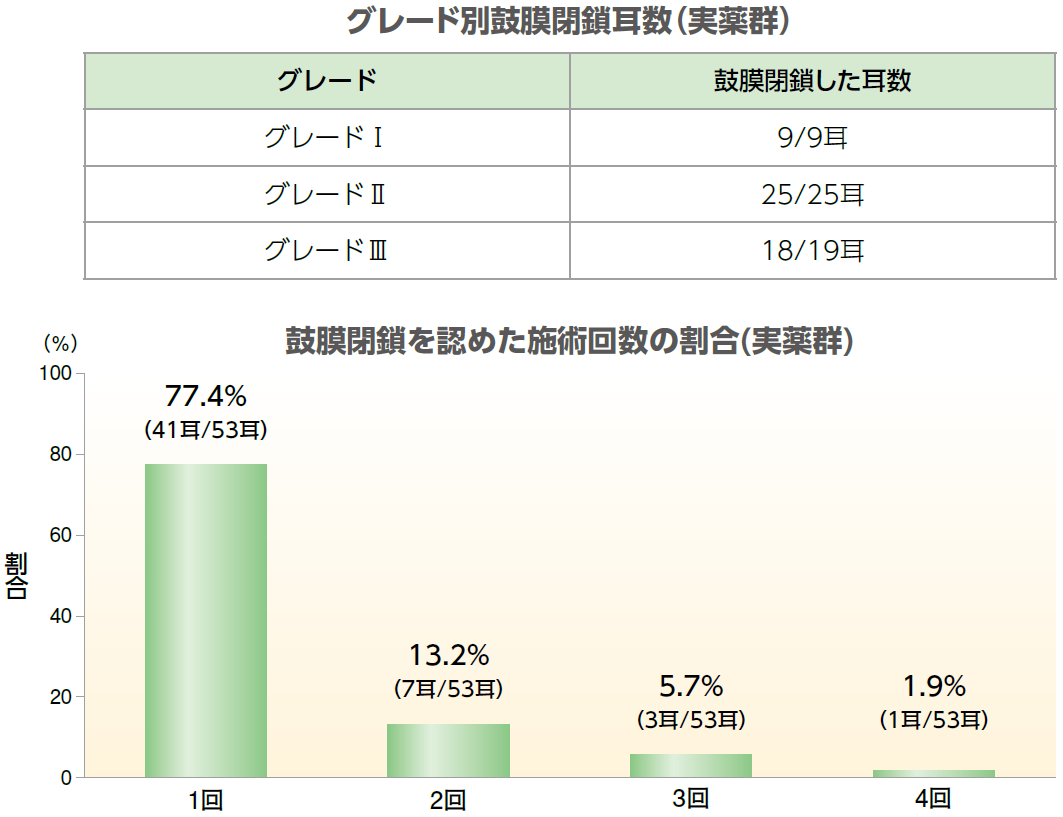
| 対象 | 慢性鼓膜穿孔患者56例63耳(トラフェルミン(遺伝子組換え)群(実薬群):48例53耳、プラセボ群:8例10耳) |
| 治療方法 | 実薬群ではトラフェルミン(遺伝子組換え)(100μg/mL、5~30μg)、プラセボ群では生理食塩液を鼓膜穿孔部より大きいゼラチンスポンジに浸潤させ、鼓膜穿孔縁の新鮮創化後、鼓膜穿孔部位を十分覆うように留置し、組織接着剤(フィブリン糊)数滴で接着・閉鎖した。 |
| 評価項目 |
有効性評価項目:
鼓膜閉鎖割合(本療法の成功指標)、耳鳴り改善割合(本療法開始前に症状がある場合、改善の有無)、耳閉感改善割合(本療法開始前に症状がある場合、改善の有無)など
安全性評価項目:
有害事象
|
| 解析計画 | 有効性評価項目の群間比較は、マン・ホイットニーのU検定により行った。 |
